| 6 熱力学第二法則 | ||
| f-denshi.com [目次へ] 更新日: 08/04/06 最後に補足説明2-[7]以下を変更しました。 | ||
| サイト検索 | ||
[1] いわゆる質点系や剛体の力学には時間の方向性を示すような法則は含まれていません。それに対して熱力学では,時間の方向性を示す法則が含まれています。この熱力学第二法則と呼ばれる法則をやや哲学的に述べると,
熱力学第二法則: 熱現象は時間に対して方向性がある。
ということができます。やかんで沸かしたお湯を放置しておくと自然にさめてしまうが,その逆は起こらないということです。このような一方的に進んでいく熱現象を不可逆変化,またはほとんど同じ意味ですが,何も変化しない状況も含めて現実に観測される変化を自発変化といいます。この表現のままでは理工学的な応用に向いていないので違った言い方・表現がなされるわけですが,特に次の4つが有名です。最初に断っておくと,これらはどれもお互い同じ内容のことをいっているのです。
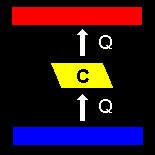
| (1) | クラウジウス (Clausius) の原理 |
他に何の痕跡も残さずに,低温から高温に熱を移すことはできない。 (やかんの水が大気の熱を自然に吸収し,熱湯となることは起こり得ません。) |
 |
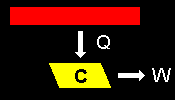
| (2) | トムソン (Tomson) の原理 |
他に何の痕跡も残さずに,ひとつの熱源から熱(>0)を奪ってそれをすべて(外への)仕事に変えることはできない。 (これが可能ならば,周りの空気から熱を奪っていくらでもエネルギー(仕事)を取り出し,さらに冷たい冷気まで手に入ります!地球温暖化問題はすぐに解決です。) |
 |
| (3) | カラテオドリ (Caratheodory) の原理 |
すべての熱平衡状態には断熱過程では到達できない状態が存在する。(すぐ近くの状態であっても) (詳しい説明はこちら)⇒ [#] |
|
| (4) | エントロピー (entropy) 増大の法則 |
系の熱力学状態が変化したときに,系が温度Tの熱源から受け取った熱量を,d'Q,エントロピー変化を
dS とすれば, d'Q ≦ TdS ( 等号は可逆な場合 ) が成り立つ。 特に孤立系( d'Q=0 ) の状態変化においては, dS ≧ 0 |
[2] その他よく見かける熱力学第二法則の別の表現は,
トムソンの原理(その2)
すべての仕事が熱にかわる現象は不可逆である。
カルノーの原理,
熱効率はカルノーサイクルにて最大。( T2>T1として )
η= Q1+Q2 = T2−T1 = 最大効率 <1 Q2 T2
オストワルドの原理
第二種永久機関は実現不可能
[3] これらは,どれも証明抜きに認めるべき原理 (公理) でひとつ一つに証明はありません。しかし,どれか一つを認めれば,それを用いて他の表現が成り立つことを証明することはできます。つまり,どの表現も同値であることを示すことができます。(問題によって使い分けるのです。)
[1] 上で述べた熱力学第二法則はどれも同値であることが証明できる言いましたが,ここでは,
(2) トムソンの原理 ⇒ (4) d'Q ≦ TdS
の証明だけ行っておきましょう。
トムソンの原理(2)はもっともらしいので,「証明なしで受け入れろ」と言われれば,たいていの人は
OK してくれるでしょう。しかし,フツ−の人が,「(4)不等式: d'Q≦TdS を証明なしに受け入れろ」 といわれてもそれは無理です。したがって,この⇒の証明は教育的演習という意味だけでなく,熱力学を体系に理解している感じるためには必要不可欠なのです。
実際,熱力学においてこの第二法則を半定量的に取り扱う場合,このエントロピー増大の法則を示す不等式(4)から出発することになるので,この2つの表現(2)と(4)のギャップを埋めておかないとなにか気持ちの悪いものが残ってしまいます。そこで,簡潔を旨とするときわ台学でも,ここのところは省略せずにきちんと説明しておこうと思います。
ということで以下,その証明です。
ステップ1
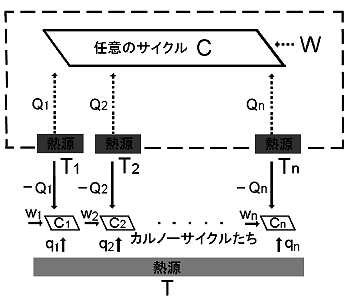 [2] まず,クラウジウス(クラジウス)の不等式を証明します。右の囲み(下図の黄色)で示している部分だけに着目してください。必ずしも可逆とは限らないサイクルCは,
[2] まず,クラウジウス(クラジウス)の不等式を証明します。右の囲み(下図の黄色)で示している部分だけに着目してください。必ずしも可逆とは限らないサイクルCは,
「温度が Tk (k=1,2,・・・,n) のn個の熱源(外界)から順々に熱を受け取り,外部に仕事(-W)を行いもとの状態に戻る。 」
とします。このとき,
Qk ≦0 [クラウジウスの不等式] Tk
が成り立ちます。これがクラウジウス(クラジウス)の不等式と呼ばれるものです。等号は,サイクルCが可逆的な過程からなるサイクル (=カルノーサイクル組み合わせ) であるときのみ成り立ちます。特に n=2 の場合については前ページで詳しく計算したとおりで,
Q1 + Q2 =0 T1 T2
を確認済みです。[#]
ここで,やや複雑なこれらの図 (右の上下2つ図の中身は同じ) の補足説明をしておいた方がよいでしょう。熱源 T1,・・・,Tn の配置はサイクルCの上方に描いていますが,これは単なるレイアウトの問題であって,温度の高低の意味はありません。また,図中で,温度Tkの熱源から熱量Qkを受け取るように矢印を描いてますが,そのうちのいくつかの熱量は ”負の値” であってもよく,そのときは熱量を与えることと解釈します。仕事についてもサイクルC (=熱機関) が受け取るとき,W>0 という符号の定義に従います。したがって,図中でサイクルCが外部に対して ”−W ” の仕事を行うと言い換えるべき場合も含めて表しています。
追加のひとこと: サイクルCは不可逆過程を含んでもかまわない という条件で考えていることは忘れてはいけません。
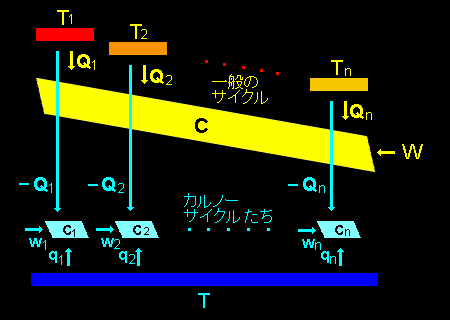 [3] さて,クラウジウスの不等式を証明するために,これからは右図の水色の過程も追加して考えます。
[3] さて,クラウジウスの不等式を証明するために,これからは右図の水色の過程も追加して考えます。
この水色の「サイクル過程たち」のやっていることですが,これは,「各カルノーサイクルCkは熱源Tから熱量qkを受けて,-wkの仕事を外部に行い,Qkの熱量を熱源Tkに与える。」というものです。
今述べた説明は図中と符号が違っているので,あれっと思ったかもしれませんが間違いではありません。「与える」⇔「受けとる」という表現はその量 (仕事,熱量) の符号によって,適宜,読み替える必要があるのは先程と同じです。また,熱源Tを図の下方に描いているのはレイアウトの都合であって,T<Tk という意味ではないことも蛇足ながら付け加えておきます。
このような状況下で,前ページの計算 [#] にならって,1サイクルごとに熱力学第一法則 (これは可逆,不可逆に関係なく成り立つ!) を使うと,
サイクルC: W + Qk=0 ・・・・・・・・(1)
サイクルCk: wk+qk−Qk=0 ・・・・・・・・・(2)
がそれぞれ成り立ちます。すべてのサイクル過程について(2)の和をとり,(1)を用いれば,
(wk+qk−Qk)
= (wk+qk)+W=0 ・・・・・・(2)'
となります。一方,各カルノーサイクルCkについて,前節で調べたように,[#]
qk + -Qk =0 ・・・・・・・・・(3) T Tk
も成り立っています。
| [4] 次に系全体で全サイクル C+ | Ck について考えます。 |
そのときは,熱源Tkに関しての熱のやり取り( Qkと−Qk )はキャンセルされて0 なので考える必要はなくなり,系全体で何が起こっているか ( =サイクルCとサイクルCkが合わせてやったことは何か) といえば,
|
という サイクル過程 となっています。そこで,この系全体のサイクルに 「トムソンの原理」[#] を適用すると,系全体が外に対して行う仕事は正であってはならないので,
−W+ (−wk)≦0 ・・・・・・(4)
でなければなりません。ここで,(2)'を用いると,
qk≦0 ・・・・・・(4)'
であることがわかります。さらに(3)を用いて書き直すと,
T Qk ≦0 Tk
となります。 そして温度,T>0 に注意して,Tで両辺を割れば,上式は「 クラジウスの不等式 」[#]
Qk ≦0 Tk
となります。
[5] これが熱力学第二法則を数式化(定量化)するための足がかりです。さらにこのクラジウスの不等式は連続的な極限移行で,
d'Q ≦0 [ クラウジウスの不等式(積分形) ] T
と書いても構わないだろうということは,前ページの2.と同じ理由です。なお,この不等式中のTは先ほどまでTk(k=1,2,・・・)と書いていた温度の連続的な極限です。つまり,必ずしも可逆的でない一般的な状態変化が起こりながら,外界(熱源)と微小な熱量d'Qをやり取りをするとき,”その瞬間”の外界温度のことです。(赤いTはここだけのサービス)
ステップ2
[6] さて,いよいよエントロピー増大法則の証明の仕上げです。そのために 状態 A から出発して,すぐ近くの 状態 B を経由して,また A に戻ってくる次のサイクルを考えてみましょう。
A 任意の過程 B → ← 可逆的な過程
このサイクルにクラジウスの不等式を用いると,
d'Q = 任意 d'Q + d'Q ≦0 T T T
ここで,真ん中の積分の第二項は,可逆な過程 B→A なので,状態 A,B のエントロピー S(A),S(B) の差であらわせることができます[#]。すると,
任意 d'Q +S(A)−S(B)≦0 ・・・ [*] T
[7] 右図にこの不等式の熱力学的な意味を図示してみました。平面上の1点は一つの熱力学平衡状態を表し,A と B を結ぶ曲線は A から B への状態変化の経路のひとつを示していますが,その過程は準静的(白実線:平面上)でも不可逆的 (水色点線:平面上になく無限異次元空間?をワープ) でも構いません。
縦軸は状態に対応するエントロピー,もしくは,
S(A)+∫(d'Q/T)
です。
まず,おさえておかなければならないのは,エントロピーは状態量なので,平衡状態A,Bが指定されれば,どのような過程を経て,その(平衡)状態に到達したかに関わらず,それらに対応するエントロピー,S(A),S(B)が一意的(関数S(X)は1価関数!)に定まります。図にはその点をS(A),S(B)で示しています。
不可逆過程で状態 A から B へ変化した場合でも状態に1対1対応するエントロピーは S(A) から点 S(B) へ移らなければいけません。
一方,図に重ね書きされている黄色,もしくは水色の曲線は,
S(A)+ d'Q ・・・ [**] T
を状態Xについて連続的にプロットしたものです。
(独白:厳密に考えれば,AとBとが極近くにあるとはいっても有意義な差がある場合,AとBとを図のような連続曲線で結べるのは可逆な場合だけであって,不可逆過程を辿った場合は,AとBとを結ぶ熱力学平衡状態が連続的に存在してない(状態を表す平面上のどこにあるのか示せない)わけだから,その路を連続曲線で結んで表すこともできないはず。したがって,水色の曲線はS(A)の点とC点とを対応を示す補助くらいに考える。
まず,AからBへの状態変化が可逆的に進んだものすれば,[*]において等号が成り立つだけでなく,その途中の状態Xにおいても常に,
可逆 d'Q = S(X)−S(A) T
が成り立ちます。すなわち,任意の可逆過程を考えて,この式の左辺の積分を実行すれば,状態AからXへ移行したときのエントロピー変化を正確に算出できることを意味しています。可逆過程を通してのみエントロピーを捕らえることができるということは,前ページでエントロピーを定義した際にも強調したことです。このとき,
S(X)=S(A)+ 可逆 d'Q T
つまり,黄色の曲線は[**]の意味のみでなく,状態 X におけるエントロピーという意味も持っています。
一方,状態 A から B への状態変化が不可逆的に進んだのであれば,
不可逆 d'Q < S(B)−S(A) [***] T
であること,すなわち,左辺の積分は,状態変化に伴うエントロピー変化よりも小さな値を算出することを意味しています。図の中で点CがS(B)よりも下に書き込んであるのはこのためです。前ページの最後のところで,不可逆過程で生じる熱量の出入りのようすはエントロピーの算出に役立たないと述べました[#]が,クラジウスの不等式は,さらに突っ込んで,
不可逆 d'Q T
を計算すると,その値はエントロピー変化,S(B)−S(A) より小さな値を与えると述べているのです。もし,外界の温度が同じ場合(等温過程)で比較するのであれば,A から B への不可逆変化で系が得る熱量は可逆変化の場合に比べて小さい,もしくは言い換えて,不可逆変化で失う熱量は可逆の場合に比べて大きいということができます。
言うまでもありませんが,状態 A から不可逆過程で状態 B に達したときは,S(B) より小さなエントロピーをもつ点Cに到達するというようなことを上の図で示しているわけはありません。エントロピーは状態量なので,系が状態 B に指定されたなら,とりうるエントロピーの値は唯一一つ S(B) です。水色の曲線は,[**] を単に計算してみたに過ぎません。
[8] ここまで述べたことを,エントロピーを主役にして言い直すと,任意の過程で,状態 A から状態 B へ変化したときのエントロピー変化 ΔS=S(B)−S(A) は積分,
任意の過程 d'Q T
に等しいか,より大きな値を持つ。特に,過程が断熱変化であれば,この積分は 0 であり,
ΔS ≧ 0
であることが言えます。この主張を孤立系に適用した,
| 孤立系における自発変化は,系のエントロピーを増大させる。 |
をエントロピー増大の法則と言います。
例えば,気体が真空中へ断熱自由膨張する過程は,孤立系の自発変化とみなせるのでエントロピーの増加を伴います。これがクラジウスの不等式からわかることです。積分∫d'Q/T がゼロであることからエントロピー変化がゼロと計算することは間違いです。不可逆な過程での熱のやり取り(ゼロの場合も含む)はエントロピーの算出には役立たないのでした。
したがって,「エントロピー増大の本質を熱の移動に求めることは間違いである。」ことは統計力学を持ち出してこなくても,熱力学の範囲内で理解できることです。不可逆過程のエントロピー変化量の正しい計算は混合エントロピー[#]の計算のところで行います。
注意が一つあります。積分 ∫d'Q/T の符号については,クラジウスの不等式は何も述べていない (条件は何もない) ということです。状態が A から B へ変化したとき,先ほどの図中のCに示めす点が S(A) より下のC' に位置するような変化を考えても構いません。クラジウスの不等式から言えることは,状態変化に伴うエントロピー変化 ΔS はこの積分より大きいということです。したがって,ΔSは積分値 ∫任意d'Q/T より小さくならない範囲で負となることもありえるのです。
先程の説明図で,S(B) を S(A) より上に書き込んだことは便宜的なもので,断熱変化に限らない一般的な状態変化では,S(B) を S(A) より下に書かなければいけないようなケースもあるのです。このような状況は例えば,分子 A と分子 B が発熱反応(系が受け取る熱量d'Qはマイナス)によって結合して一つの分子Cが生成するというようなケースで起こり得ます。
下図には3とおりの∫任意d'Q/T の値によって,現実にとり得る終状態のエントロピー S(B) の範囲を黄色の直線で示しています。真ん中の d'Q=0 の場合が狭い意味での「エントロピー増大の法則」に対応しています。(08/07/26 & 08/11/04修正)
|
|
| クラジウスの不等式の意味を3つのケースに場合分けして示した。 |
[9] さて,熱力学第二法則の微分形は,[***]において,A から B への変化が微小であるならば,
d'Q不可逆 −dS<0 T
と書き直すことができます。すなわち,等号が成り立つ可逆な場合も含めて,
d'Q≦TdS [熱力学第二法則]
と書くことができます。
ここでの議論をまとめると,トムソンの原理を仮定し,クラウジウスの不等式を導き,そこから熱力学第二法則が得ました。
補足 : 上級者へのコメント:(熱力学温度とは)
ここでの熱力学第2法則の不等式表現 d'Q≦TdS を導くにあたって,熱機関の作業物質として理想気体を仮定しています。しかし,この不等式は理想気体に限らず,液体,固体をも含むあらゆる熱現象に対して広く成立する法則とみなします。そういった意味でこのページの説明だけでは不満が残る人もいるはずです(歴史的にもそうだった)。理想気体の性質を用いずに熱力学第2法則の不等式表現を得る一般的方法は,クラウジウスの原理,またはムソンの原理からカラテオドリの原理を示し,さらに「積分分母」という実に数学的な意味での熱力学温度(←ほとんど数学的な温度です。)とエントピーの存在(=定義できること)をセットで証明し,最後に不可逆変化では,d'Q<TdSであることを証明します。
そこまで公理主義的でない折衷案としては,任意の作業物質を用いたカルノーサイクルにおいて,その熱機関としての効率が,
η=1− |Q1| ; Q2:高熱源から受け取った熱量, |Q1|:低熱源へ捨てた熱量 Q2
で与えられることを示し,「このQ1とQ2だけで決まる物質依存性を持たない,|Q1|/Q2を利用して熱力学温度なるものを定義すればより普遍的であろう」と主張するものです。そして特に作業物質によらないということから理想気体のときの,|Q1|/Q2=T1/T2なる関係から,「PV=nRTに従う理想気体の絶対温度Tを熱力学温度と定義する」 とする説明されることになります。このやり方ではカルノーサイクルの存在を仮定して熱力学的温度を定義することになりますが,カラテオドリによると,熱力学温度の定義に真に必要なのはその中の「準静的な過程」という部分だけなので,カルノーサイクルを用いるやり方ではオーバースペックとなっているのです。
11/07/28
よくある質問:
ここでの(クラウジウスの)導出方法によるならば,
(1) 熱力学第二法則 : d'Q≦TdS は理想気体に対してしか適用できないのではないか?
(2) 熱力学第二法則 : d'Q≦TdS は準静的な過程が存在する状態どおしの間でしか成り立たないのではないか?
私の回答:
一言で答えるならば,「理想気体以外にも適用でき,2つの状態間に準静的な過程が存在しようがしまいが成立する」ということです。
なぜならば,「 d'Q≦TdS 」は原理,法則に当たるもので,もともとそのまま証明なしに受け入れる類のものだからです。
確かに,トムソンの原理からこの不等式を導くときに,「理想気体」や「準静的な過程」を利用しています。しかし,それらはこの不等式を考案するための思考実験に用いた道具であって,どちらも現実に存在するものではないのです。その思考実験の結果,抽出された仮説:「 すべての現象において,d'Q≦TdS が成立する。」が本当に原理・法則としてふさわしいものかどうかは,そこから演繹される様々な理論,予測が現実世界で起こる現象を正しく,矛盾なく説明できるかどうかで評価されるべきなのです。思考実験がどのようなものであったかは関係ありません。
つまり,質問(1),(2)を肯定的に「できる」として証明することは,「第二法則は証明するようなモノではない」という意味において,できないということです。しかし,証明できないからといって,熱力学第二法則が直ちに誤りということにはなりません。実際に「実在の世界で第二法則は正しくない」と証明するするには,なんらかの反例を見つけ出し,否定することですが,それが実現するまでは熱力学第二法則は正しいとみなさざるを得ないと言うのが私の理解です。
また,「熱力学は理想的物質の準静的な変化においてだけ成り立つ理論」と考えるのも同様に誤りです。これも状態量であるエントロピーを定義する際の理想的な物質,理想的な過程という道具立てに気をとられた結果の誤解だと思います。一度,状態量,S,P,V,Tなどが定義されれば,その平衡状態にどうやってたどり着いたか,つまり,準静的か不可逆的かに一切関係なく,(理論上)熱力学状態は一意的に定まります。したがって,そのような状態量の大小関係などの比較によって導かれる平衡熱力学の理論,帰結はいかなる平衡状態に対しても成立するものです。
熱力学は具体的操作方法によって異なってしまう熱量,仕事といった「過程の量」を脇役に落とし,その代わり「状態量」を主役に抜擢,理論の中心に据えることで,普遍性のある定量的理論体系の構築に成功しているといえます。 熱力学といいながら,熱は主役じゃないんです!
主役の8人衆はこちら ⇒ SPVTUGHF