状態方程式
| Appendix 1 ファンデルワールスの 状態方程式 |
||
| f-denshi.com [目次へ] 更新日: 21/10/31 まだまだ進化する | ||
| サイト検索 | ||
[1] 実在気体のモデルとして,ファンデルワールス気体があります。
| ファンデルワールスの状態方程式 ( van der Waals Equation ) 適当な定数を a,b >0 として, もしくは,気体の平均モル体積を v = V/n を用いた, をファンデルワールスの状態方程式と呼ぶ。 |
||||||||||||||||
このファンデルワールスの状態方程式は,理想気体の状態方程式 P*v*=RT と比較して,
P*(理想気体の圧力) ⇔ P+a/v2
v*(理想気体の体積) ⇔ v−b
と置き換えられています。ここで,a/v2は,
(1) 実在の分子どおしが接近したときには引力(=ファンデルワールス力)が働く。
ということを考慮したものです。そのため同じ体積(モル濃度)で比較すると,実在気体で観測される圧力Pは,分子間力を考慮しない理想気体の圧力P*に比べて小さくなるはずです。つまり,気体分子どおしが自ら集まろうとする性質のため,実在気体を閉じ込めておく外壁に及ぼす圧力は理想気体に比べてa/v2だけ少なくてすむはずだということをファンデルワールスの状態方程式の圧力 P ⇔ P*−a/v2で表しています。彼はこれを負の内部圧力と呼びました。
a/v2 の意味
また,Pv/v 〜 a/v2 であるので, a/v2 は体積当たりのエネルギーの次元を持ちます。では,このエネルギーは何かということになりますが,それは,
分子間引力のポテンシャルエネルギー
と考えられます。実際,後で示すように,
∂U =a/v2 ∂V T
という関係があります[#]。
[1-2] 一方,b は,
(2)実在の分子の体積はゼロでない大きさをもち,気体の体積に比べて無視できない。
という排除体積効果を考慮したものです。そのため,実在気体のモル体積vは理想気体の体積 v*よりbだけ大きくなることを,v ⇔ v*+b で表しています。(見方を換えると,気体分子の理想的に(自由に)動き回れる空間はみかけの空間より小さい。)
もしくは,
P = RT − a ( v−b ) v2
とファンデルワールスの状態方程式 [*]式を変形してみれば,
第1項より,
b>0 は気体の圧力を増加させる因子である
第2項より,
a>0 は気体の圧力を低下させる因子である
ことは容易に理解できます。
[2] さて,このファンデルワールスの状態方程式はどんな特徴を持っているのでしょうか。状態方程式[*]を陰関数として,
Pv3−(bP+RT)v2+av−ab = 0
のようにv の3次方程式に書き直してみればわかるように,関数 P(v ),
P(v) = RT − a ・・・ [**] v−b v2
は一般的には2つの極値,その間に1つの変曲点を持つと推察されます。しかし,
∂P =− RT + 2a = 0 ・・・(1) ∂v (v−b )2 v3
∂2P = 2RT − 6a = 0 ・・・(2) ∂v2 (v−b )3 v4
を同時に満たすときは,1つの停留点をもつ減少関数となります。このとき,[**],(1),(2) を連立して解くと,
vc =3b, Tc = 8a , Pc = a 27bR 27b2
を満足しなければなりません。この状態 (Pc,vc,Tc) を臨界点と言います。
ヒント
(1)を, y = RTv3=2a(v−b)2,
(2)を, y = 2RTv4=6a(v−b )3
として,図示すれば,解の様子を理解しやすい。
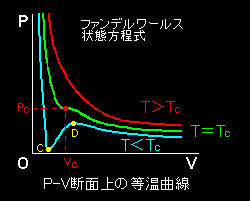
[3] この臨界点を境にこの状態方程式で表される気体の性質は大きく変わります。
T>Tc であれば常に,(1)は負,(2)は正の値をとり,P(v)は下に凸である単調減少関数です。一方,
T<Tcであれば,(1)は2つの正の解をもちその解の間にひとつの変曲点を持ちます。この概略を図示すると下図のようになります。
具体的な実在気体に対する a,b の値は,久保亮五編「大学演習 熱学・統計力学」(裳華房)などにあります。第27版では9ページです。
T>Tc のとき,ファンデルワールス気体を圧縮していくと全圧力範囲で気体として振舞います。
一方,T<Tcのときは,等温曲線上の傾きが正,すなわち,
∂P > 0 ∂V T
となっている区間CDが出現します(上図参照)。しかし,この領域に対応する状態は熱力学的に不安定であり[#],気体は”熱平衡状態”としては存在することができません。(正確に言えば,物質の三態によらず存在し得ない。) その意味でこの区間での状態方程式はナンセンスなわけです。
しかし,まったくこのような2つの極値を示す等温曲線に熱力学的な意味を見出せないかといえば,そうではありません。この状態方程式が液体に対しても有効なことを仮定すれば,この温度領域での等温曲線は気体から液体への相転移現象を半定量的に説明できる”便利な”状態方程式となっているのです。
[4] 2つの極値をもつ等温曲線の解釈は,ファンデルワールス気体を体積が十分大きな状態から徐々に圧縮してゆくと,右図のBの点において液化が始まり,Bの状態の気体が消滅した分量だけAの状態に液体として出現し,この2相が共存するというものです。やや唐突にも感じられますが,当初はファンデルワールス状態方程式は液体に対しても適用可能であると考えられていたようです。
このような液化が起こる圧力P’は次のように求めることができます。
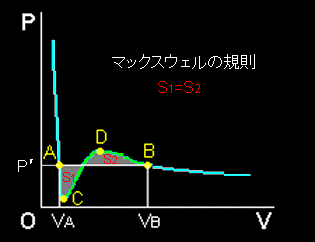
熱平衡条件から,A,Bにおける平均モルギブス自由エネルギーが等しいとして,
uA+P’A−T0sA=uB+P’vB−T0sB
これを書き直して,
sB−sA= uB−uA +P0 vB−vA ・・・ (4) T0 T0
一方,熱力学第一法則 d'Q=du+Pdv を利用して,状態A→Bにそって次のような積分を実行すると,
sB−sA= d'Q T
= du+Pdv T
= 1 du+ 1 vB Pdv T0 T0 vA
= uB−uA + 1 vB Pdv ・・・・ (5) T0 T0 vA
(4)と(5)を比較して,
P’ (vB−vA)= vB Pdv ←いわゆる平均値の定理というやつです。 vA
これは図中の面積,S1=S2 という幾何学的意味をもっており,マックスウェルの規則と呼ばれます。そして,両辺を(vB−vA)で除せば,液化の起こる圧力P’が得られます。
[5] 最後に P-V 図の領域 A-C,B−Dについてコメントしておきます。もし,相転移を考慮しないのであれば,この領域は平衡論的には安定に存在することが可能な状態なはずです。事実,速度論的に相転移現象が追いつかないときは,この領域にある状態を観察することができるのです。
たとえば,曲線 B-D 上の状態は過飽和蒸気と呼ばれる気体に対応すると考えます。先ほどのファンデルワールスの状態方程式の解釈によれば,気体を圧縮していってB点に到達したとき,(気体と液体のモルギブス自由エネルギーが等しくなり,)液体の生成が始まるはずです。
しかし,実在の気体では気相と液相との境界には界面張力が存在し,これに打ち勝って界面を形成するための界面形成エネルギーが液滴の成長に必要となります。そのため,生成した液滴がまだ小さくて界面の影響が無視できないとき,液滴は速やかに成長することができないのです。したがって,液滴の成長より速く,気体状態がそのまま圧縮される場合があり,この様子が過飽和蒸気として観察されるのです。
これより詳細な定量的な議論は二相共存平衡,界面の熱力学に譲ることとします。
[1]
| - | 熱膨張率 β |
等温圧縮率 κ |
圧力係数 γp |
|||||||||||||||||||||||||||
| 定義 |
|
|
|
|||||||||||||||||||||||||||
| 理想気体 |
|
|
|
|||||||||||||||||||||||||||
| ファンデル |
|
|
|
[2] 第一法則から
| - | (1) | (2) | (3) | (4) | ||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
| 実験値で 表現 |
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
| =Tγp−P | =-TβV−P(-κV) | =Tγp−1/κ | =-TβV+V | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 理想気体 | 0 | 0 | 0 | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ファンデル |
|
|
|
|
| 3Pv2−2(Pb+RT)v+a = Pv2−a+ | 2ab |
| v |
SUSTAINABLE TOKIWADAIGAK SINCE 2002
ファンデルワールス状態方程式のビリアル展開係数
ファンデルワールス気体の状態方程式,
| P+ | a | ( v−b ) = RT ・・・[*] | |||
| v2 | |||||
において,b<<v であれば,
| Pv = RT | v | − | a | ||
| v−b | RTv |
| = RT | 1+ | -a | + | b | + | b2 | + | b3 | + ・・・・・ | ||
| vRT | v | v2 | v3 |
| = RT | 1+ | b− | a | 1 | + | b2 | + | b3 | + ・・・・・ | ||||
| RT | v | v2 | v3 |
と級数に展開できます。ここで,r<<1のときの級数展開,
1 = 1+r+r2+・・・+rn+ ・・・・ 1−r
を用いています。そして,この1次,2次の項を
第2ビリアル係数:
b− a RT
第3ビリアル係数:
b2
といいます。
計算
⇔ Pv3−(Pb+RT)v2+av−ab = 0
|
||||||||||||||||||||||||||||||
Pv3−(Pb+RT)v2+av−ab = 0 を陰関数として微分する。
熱膨張率β vで微分 P=一定
| 3Pv2−2(Pb+RT)v−Rv2 | ∂T | +a=0 ⇔ 3Pv2−2(Pb+RT)v+a)/Rv2= | ∂T | ||||||||||
| ∂v | P | ∂V | P | ||||||||||
| ⇔ β= | 1 | ∂T | = | Rv | |||
| v | ∂v | P | 3Pv2−2(Pb+RT)v+a |
等温圧縮率κ Pで微分 (T=一定)
v3+3v2 ∂v/∂P−bv2−2(Pb+RT)v ∂v/∂P a∂v/∂P = 0
| v3+3v2 | ∂v | −bv2−2(Pb+RT)v | ∂v | +a | ∂v | =0 | |||||||||
| ∂P | T | ∂P | T | ∂P | T |
| ⇔ v3−bv2 | = −(3v2−2(Pb+RT)v+a) | ∂v | ||||
| ∂P | T | |||||
| ⇔ κ= | -1 | ∂v | = | (v−b)v | |||
| v | ∂P | T | 3Pv2−2(Pb+RT)v+a |
圧力係数γp Tで微分 V=一定
Pv3−(Pb+RT)v2+av−ab = 0
| v3 | ∂P | −bv2 | ∂P | +Rv2=0 | ||||||
| ∂T | T | ∂T | T |
| γp= | ∂P | = | R | ||||||||
| ∂T | T | (v−b) |
(1) 内部エネルギー
| Tγp−P = | RT | −P = | a |
| (v−b) | v2 |
(2) 内部エネルギー
| -TβV−P(-κV)= | −RTv2 | + | P(v−b)v2 |
| 3Pv2−2(Pb+RT)v+a | 3Pv2−2(Pb+RT)v+a |
| = | (P(v−b)−RT)v2 | = | −(v−b)a |
| 3Pv2−2(Pb+RT)v+a | 3Pv2−2(Pb+RT)v+a |
| ↓ 3Pv2−2(Pb+RT)v+a = Pv2−a+ | 2ab |
| v |
| = | −(v−b)a |
| Pv2−a+2ab/v |
| = | −(v−b)(a/v2) |
| P−(a/v2)+2(a/v2)(b/v) |
(3) エンタルピー
| Tγp−1/κ= | RT | − | 3Pv2−2(Pb+RT)v+a | |||
| (v−b) | (v−b)v |
| = | −3Pv2+2(Pb+RT)v−a+RTv |
| (v−b)v |
↓ Pv3+av−ab = (Pb+RT)v2
| = | −3Pv3+2(Pv3+av−ab)−av+RTv2 |
| (v−b)v2 |
| = | (RT−Pv)v2+av−2ab |
| (v−b)v2 |
↓(Pv−RT)v2=(Pbv−a)v+ab (Pv−RT)v2−ab=(Pbv−a)v
| = | (Pv2−a)b | = | (P−a/v2)b |
| (v−b)v2 | (v−b) |
(4) エンタルピー
| V-TβV= | 3Pv3−2(Pb+RT)v2+av−RTv2 |
| 3Pv2−2(Pb+RT)v+a |
↓ Pv3+av−ab = (Pb+RT)v2 Pv3−(Pb+RT)v2+av−ab = 0
| = | 3Pv3−2(Pv3+av−ab)+av−RTv2 |
| 3Pv2−2(Pb+RT)v+a |
| = | (Pv−RT)v2−av+2ab |
| 3Pv2−2(Pb+RT)v+a |
↓(Pv−RT)v2=(Pbv−a)v+ab
| = | Pbv2−2av+3ab |
| 3Pv2−2(Pb+RT)v+a |
| = | Pbv2−2av+3ab |
| Pv2−a+2ab/v |
| = | Pb−2a/v+3ab/v2 |
| P−a/v2+2(a/v2)(b/v) |
対応状態の法則
臨界定数を体積,温度圧力の単位として使用すると,すなわち,
| v = | v | , t = | T | , p = | P | とおくと, |
| vc | Tc | Pc |
を定義します。すると,ファンデルワールスの状態方程式は,
p+ 3 ( 3v−1 ) = 8t v2
または,
p = 8t − 3 3v − 1 v2
と,物質固有の a,b を含まない式の状態方程式で書き表すことができます。
ファンデルワールスの状態方程式に限らず,気体分子間のポテンシャツが一定の条件を満たせば,統計力学的に,2の定数を含む気体の状態方程式はすべてこの形となることを示すことができる。
臨界定数から
Pcvc = 3 = 0.375 RTc 8
Beattie-Bridgemanの状態方程式